परमाणु की संरचना के विवरण में परमाणु के नाभिक की चर्चा और परमाणु के इलेक्ट्रॉन कक्षाओं की चर्चा शामिल है। सरल शब्दों में, इलेक्ट्रॉन ऑर्बिटल्स नाभिक के चारों ओर संकेंद्रित गोले होते हैं, जहां इलेक्ट्रॉन रहते हैं, प्रत्येक क्षेत्र एक विशेष ऊर्जा मूल्य के साथ जुड़ा हुआ है। इलेक्ट्रॉन क्षेत्र नाभिक के जितना करीब होता है, उस क्षेत्र में इलेक्ट्रॉनों की ऊर्जा उतनी ही कम होती है। दो मुख्य प्रकार के ऑर्बिटल्स परमाणुओं के बंधन में भाग लेते हैं। ये ऑर्बिटल्स वे हैं जो वैलेंस इलेक्ट्रॉनों को धारण करते हैं। S और p ऑर्बिटल्स एक दूसरे के साथ सहसंयोजक बंधनों में परमाणुओं की बॉन्डिंग में भाग लेते हैं। जैसे-जैसे आप आवर्त सारणी को नीचे लाते हैं, तत्वों की प्रत्येक पंक्ति एक अन्य प्रकार की कक्षीय जोड़ी बनाती है जो परमाणु के इलेक्ट्रॉनों के लिए उपलब्ध होती है। परमाणु के इलेक्ट्रॉन न्यूनतम ऊर्जा कक्षा से उच्चतम ऊर्जा कक्षा में कक्षा को भरते हैं और प्रत्येक कक्षीय दो इलेक्ट्रॉन रखता है। जब दो इलेक्ट्रॉन ऑर्बिटल्स पर कब्जा कर लेते हैं, तो वे ऑर्बिटल्स की तुलना में अधिक ऊर्जा रखते हैं जो केवल एक इलेक्ट्रॉन रखते हैं।
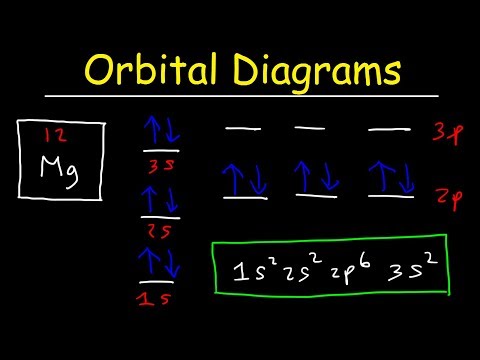
ब्याज के परमाणु में इलेक्ट्रॉनों की संख्या निर्धारित करें। परमाणु में इलेक्ट्रॉनों की संख्या तत्व की परमाणु संख्या के बराबर है।
प्रश्न में तत्व के लिए इलेक्ट्रॉन विन्यास लिखें। क्रम 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p और 5s में परमाणु के ऑर्बिटल्स भरें। प्रत्येक एस ऑर्बिटल दो इलेक्ट्रॉनों को पकड़ सकता है, प्रत्येक पी ऑर्बिटल छह इलेक्ट्रॉनों को पकड़ सकता है और प्रत्येक डी ऑर्बिटल 10 इलेक्ट्रॉनों को पकड़ सकता है।
अंतिम या भरे हुए कक्षीय को छोड़ें। इन ऑर्बिटल्स में तत्व के लिए वैलेंस इलेक्ट्रॉन होते हैं। उदाहरण के लिए, सिलिकॉन की वैलेंस ऑर्बिटल का पता लगाएं। सिलिकॉन तत्व संख्या 14 है, इसलिए इसमें 14 इलेक्ट्रॉन हैं। सिलिकॉन के लिए उपलब्ध कक्षा 1s, 2s, 2p, 3s और 3p हैं। इलेक्ट्रॉनों 1s, 2s, 2p और 3s ऑर्बिटल्स को भरते हैं और अंतिम दो इलेक्ट्रॉनों को 3p ऑर्बिटल्स में रखते हैं। सिलिकॉन में चार वैलेंस इलेक्ट्रॉन होते हैं। दो 3 ऑर्बिटल से आते हैं और 2 3 पी ऑर्बिटल्स से आते हैं।