विषय
- पैरामैग्नेटिक बनाम डायमैग्नेटिक एलिमेंट्स
- गणना करना कि क्या एक तत्व पैरामैग्नेटिक या डायमैगनेटिक है
- पैरामैग्नेटिक परमाणुओं की एक सूची
- पैरामैग्नेटिक कम्पाउंड्स
सभी परमाणु किसी न किसी तरह से चुंबकीय क्षेत्र में प्रतिक्रिया करते हैं, लेकिन वे नाभिक के आसपास के परमाणुओं के विन्यास के आधार पर अलग-अलग प्रतिक्रिया करते हैं। इस विन्यास के आधार पर, एक तत्व डायमैगनेटिक, पैरामैग्नेटिक या फेरोमैग्नेटिक हो सकता है। ऐसे तत्व जो डायमैग्नेटिक हैं - जो वास्तव में उन सभी में हैं, एक हद तक - एक चुंबकीय क्षेत्र द्वारा कमजोर रूप से निरस्त किए जाते हैं, जबकि पैरामैग्नेटिक तत्व कमजोर रूप से आकर्षित होते हैं और चुंबकित हो सकते हैं। फेरोमैग्नेटिक सामग्रियों में भी चुम्बकीय बनने की क्षमता होती है, लेकिन पैरामैग्नेटिक तत्वों के विपरीत, चुम्बकीयकरण स्थायी होता है। दोनों परमैग्नेटिज्म और फेरोमैग्नेटिज्म, डायनामैग्नेटिज्म से ज्यादा मजबूत होते हैं, इसलिए जो तत्व या तो पैरामैग्नेटिज्म या फेरोमैग्नेटिज्म प्रदर्शित करते हैं, वे अब डायमैगनेटिक नहीं हैं।
कमरे के तापमान पर केवल कुछ तत्व फेरोमैग्नेटिक होते हैं। इनमें लोहा (Fe), निकल (Ni), कोबाल्ट (Co), गिडोलिनियम (Gd) और - जैसा कि वैज्ञानिकों ने हाल ही में खोजा है - रुथेनियम (Ru)। आप इनमें से किसी भी धातु को एक चुंबकीय क्षेत्र में उजागर करके एक स्थायी चुंबक बना सकते हैं। पैरामैग्नेटिक परमाणुओं की सूची बहुत लंबी है। एक चुंबकीय क्षेत्र की उपस्थिति में एक पैरामैग्नेटिक तत्व चुंबकीय हो जाता है, लेकिन जैसे ही आप क्षेत्र को हटाते हैं यह अपने चुंबकीय गुणों को खो देता है। इस व्यवहार का कारण बाहरी कक्षीय खोल में एक या एक से अधिक अप्रकाशित इलेक्ट्रॉनों की उपस्थिति है।
पैरामैग्नेटिक बनाम डायमैग्नेटिक एलिमेंट्स
पिछले 200 वर्षों के दौरान विज्ञान में सबसे महत्वपूर्ण खोजों में से एक बिजली और चुंबकत्व का परस्पर संबंध है। क्योंकि प्रत्येक परमाणु में नकारात्मक रूप से आवेशित इलेक्ट्रॉनों का एक बादल होता है, इसमें चुंबकीय गुणों की क्षमता होती है, लेकिन चाहे वह फेरोमैग्नेटिज़्म, परमज्ञानवाद या डायमेग्नेटिज़्म प्रदर्शित करता हो, यह उनके विन्यास पर निर्भर करता है। इसकी सराहना करने के लिए, यह समझने की आवश्यकता है कि इलेक्ट्रॉन कैसे तय करते हैं कि कौन सा नाभिक के आसपास परिक्रमा करता है।
इलेक्ट्रॉनों में स्पिन नामक एक गुणवत्ता होती है, जिसे आप रोटेशन की दिशा के रूप में देख सकते हैं, हालांकि यह उससे अधिक जटिल है। इलेक्ट्रॉनों में "स्पिन-अप" (जिसे आप दक्षिणावर्त रोटेशन के रूप में कल्पना कर सकते हैं) या "स्पिन-डाउन" (वामावर्त) कर सकते हैं। वे खुद को बढ़ते हुए, कड़ाई से परिभाषित दूरी पर स्थित होते हैं, जिन्हें शेल कहा जाता है, और प्रत्येक शेल के भीतर उप-भाग होते हैं, जिनमें कक्षा की एक असतत संख्या होती है जो अधिकतम दो इलेक्ट्रॉनों द्वारा कब्जा कर सकते हैं, प्रत्येक में विपरीत स्पिन हो सकता है। एक कक्षीय पर कब्जा करने वाले दो इलेक्ट्रॉनों को युग्मित कहा जाता है। उनके स्पिन रद्द हो जाते हैं और वे कोई शुद्ध चुंबकीय क्षण नहीं बनाते हैं। दूसरी ओर एक कक्षीय पर कब्जा करने वाला एकल इलेक्ट्रॉन अप्रभावित है, और यह एक शुद्ध चुंबकीय क्षण में परिणाम करता है।
डायमैग्नेटिक तत्व वे होते हैं जिनमें कोई अप्रकाशित इलेक्ट्रॉन नहीं होते हैं। ये तत्व कमजोर रूप से एक चुंबकीय क्षेत्र का विरोध करते हैं, जिसे वैज्ञानिक अक्सर एक मजबूत विद्युत चुम्बक के ऊपर पाइरोमिक ग्रेफाइट या एक मेंढक (हाँ, एक मेंढक!) जैसे डायमैग्नेटिक सामग्री को प्रदर्शित करके प्रदर्शित करते हैं। पैरामैग्नेटिक तत्व वे होते हैं जिनमें अप्रकाशित इलेक्ट्रॉन होते हैं। वे परमाणु को एक शुद्ध चुंबकीय द्विध्रुवीय क्षण देते हैं, और जब कोई क्षेत्र लागू होता है, तो परमाणु क्षेत्र के साथ संरेखित होते हैं, और तत्व चुंबकीय हो जाता है। जब आप फ़ील्ड को निकालते हैं, तो थर्मल ऊर्जा संरेखण को यादृच्छिक बनाने के लिए हस्तक्षेप करती है, और चुंबकत्व खो जाता है।
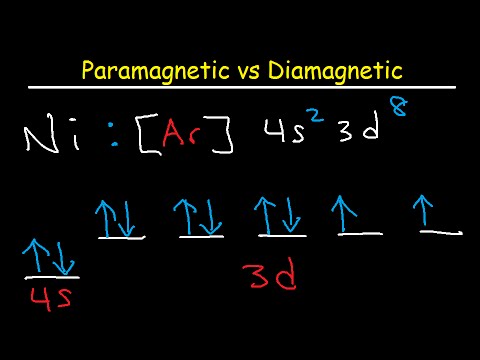
गणना करना कि क्या एक तत्व पैरामैग्नेटिक या डायमैगनेटिक है
इलेक्ट्रॉन नाभिक के चारों ओर गोले भरते हैं जो शुद्ध ऊर्जा को कम करता है। वैज्ञानिकों ने तीन नियमों की खोज की है जो कि ऐसा करते समय उनका अनुसरण करते हैं, जिसे औफब्रु सिद्धांत, हंड्स नियम और पाउली अपवर्जन सिद्धांत के रूप में जाना जाता है। इन नियमों को लागू करते हुए, रसायनज्ञ यह निर्धारित कर सकते हैं कि एक नाभिक के आसपास के प्रत्येक उपधारा में कितने इलेक्ट्रॉ होते हैं।
यह निर्धारित करने के लिए कि क्या कोई तत्व डायनामैग्नेटिक या पैरामैग्नेटिक है, इसकी आवश्यकता केवल वैलेंस इलेक्ट्रॉनों को देखने के लिए है, जो कि सबसे बाहरी उपधारा पर कब्जा कर लेते हैं। यदि बाहरी उपधारा में अप्रकाशित इलेक्ट्रॉनों के साथ कक्षाएँ हैं, तो तत्व पैरामैग्नेटिक है। नहीं तो इसका डायनामैग्नेटिक। वैज्ञानिक उप-प्रजातियों की पहचान s, p, d और f के रूप में करते हैं। इलेक्ट्रॉन विन्यास को लिखते समय, कन्वेंशन वैलेंस इलेक्ट्रॉनों को पूर्ववर्ती तालिका में प्रश्न में तत्व से पहले महान गैस द्वारा पूर्ववर्ती है। नोबल गैसों ने इलेक्ट्रॉन ऑर्बिटल्स को पूरी तरह से भर दिया है, यही वजह है कि वे निष्क्रिय हैं।
उदाहरण के लिए, मैग्नीशियम (Mg) के लिए इलेक्ट्रॉन विन्यास 3 s है2। सबसे बाहरी उपधारा में दो इलेक्ट्रॉन होते हैं, लेकिन वे अप्रकाशित होते हैं, इसलिए मैग्नीशियम पैरामैग्नेटिक होता है। दूसरी ओर, जस्ता (Zn) का इलेक्ट्रॉन विन्यास 4 जी है23 डी10। इसके बाहरी खोल में कोई अप्रकाशित इलेक्ट्रॉन नहीं है, इसलिए जस्ता डायनामैग्नेटिक है।
पैरामैग्नेटिक परमाणुओं की एक सूची
आप प्रत्येक तत्व के चुंबकीय गुणों की गणना उनके इलेक्ट्रॉन विन्यासों को लिखकर कर सकते हैं, लेकिन सौभाग्य से, आपके पास नहीं है। केमिस्ट्स ने पहले से ही पैरामैग्नेटिक तत्वों की एक तालिका बनाई है। वे इस प्रकार हैं:
पैरामैग्नेटिक कम्पाउंड्स
जब परमाणु यौगिकों का निर्माण करते हैं, तो उन यौगिकों में से कुछ भी उसी कारण से परमज्ञानवाद का प्रदर्शन कर सकते हैं जो तत्व करते हैं। यदि यौगिक कक्षाओं में एक या एक से अधिक अप्रकाशित इलेक्ट्रॉन मौजूद हैं, तो यौगिक पैरामैग्नेटिक होगा। उदाहरणों में आणविक ऑक्सीजन (O) शामिल हैं2), आयरन ऑक्साइड (FeO) और नाइट्रिक ऑक्साइड (NO)। ऑक्सीजन के मामले में, एक मजबूत इलेक्ट्रोमैग्नेट का उपयोग करके इस सर्वोपरिवाद को प्रदर्शित करना संभव है। यदि आप इस तरह के चुंबक के ध्रुवों के बीच तरल ऑक्सीजन डालते हैं, तो ऑक्सीजन ध्रुवों के चारों ओर इकट्ठा हो जाएगी क्योंकि यह ऑक्सीजन गैस का एक बादल बनाने के लिए वाष्पीकृत हो जाता है। तरल नाइट्रोजन के साथ एक ही प्रयोग करें (एन2), जो पैरामैग्नेटिक नहीं है, और ऐसा कोई बादल नहीं बनेगा।
यदि आप एक पैरामैग्नेटिक यौगिक सूची को संकलित करना चाहते हैं, तो आपको इलेक्ट्रॉन विन्यास की जांच करनी होगी। क्योंकि इसके अनियंत्रित इलेक्ट्रॉनों में बाहरी वैलेंस गोले जो पैरामैग्नेटिक गुण को सर्वोत्तम करते हैं, ऐसे इलेक्ट्रॉनों के साथ यौगिक सूची बनाते हैं। यह हमेशा सच नहीं है, यद्यपि। ऑक्सीजन अणु के मामले में, वैलेंस इलेक्ट्रॉनों की एक समान संख्या होती है, लेकिन वे प्रत्येक अणु की समग्र ऊर्जा स्थिति को कम करने के लिए एक कम ऊर्जा स्थिति पर कब्जा कर लेते हैं। उच्चतर कक्षीय क्षेत्र में इलेक्ट्रॉन युग्म के बजाय, निम्न कक्षा में दो अप्रभावित इलेक्ट्रॉन होते हैं, जो अणु को परा-चुंबकीय बनाता है।