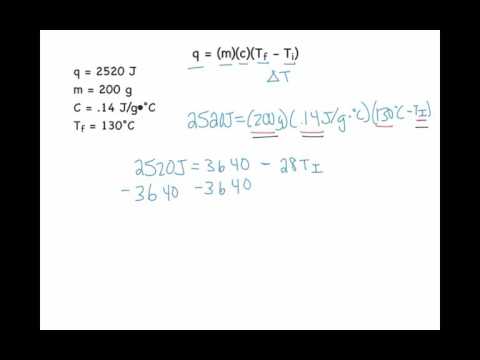
विषय
- टीएल; डीआर (बहुत लंबा; डिडंट रीड)
- विशिष्ट गर्मी के लिए समीकरण
- प्रारंभिक तापमान का पता लगाने के लिए विशिष्ट गर्मी का उपयोग करना
- विशिष्ट गर्मी और चरण परिवर्तन
गर्म करने के लिए कौन सी ऊर्जा अधिक लगती है: वायु या पानी? कैसे पानी के बारे में धातु या पानी बनाम सोडा की तरह एक और तरल?
ये सवाल और कई अन्य विशिष्ट गर्मी नामक पदार्थ की संपत्ति से संबंधित हैं। विशिष्ट ताप किसी पदार्थ के तापमान को एक डिग्री सेल्सियस बढ़ाने के लिए आवश्यक प्रति इकाई द्रव्यमान की ऊष्मा की मात्रा है।
इसलिए हवा की तुलना में पानी को गर्म करने में अधिक ऊर्जा लगती है क्योंकि पानी और हवा में अलग-अलग विशिष्ट हीट होती है।
टीएल; डीआर (बहुत लंबा; डिडंट रीड)
सूत्र का उपयोग करें:
क्यू = mcΔT, भी लिखा क्यू = एमसी (टी - टी0)
प्रारंभिक तापमान को खोजने के लिए (टी0) एक विशिष्ट गर्मी की समस्या में।
वास्तव में, पानी में किसी भी "सामान्य" पदार्थ के उच्चतम विशिष्ट हीट में से एक है: इसका 4.186 जूल / ग्राम ° C। यही कारण है कि पानी मशीनरी, मानव शरीर और यहां तक कि ग्रह के तापमान को नियंत्रित करने में इतना उपयोगी है।
विशिष्ट गर्मी के लिए समीकरण
आप किसी पदार्थ का प्रारंभिक तापमान ज्ञात करने के लिए विशिष्ट ऊष्मा की संपत्ति का उपयोग कर सकते हैं। विशिष्ट गर्मी के लिए समीकरण आमतौर पर लिखा जाता है:
क्यू = mcΔT
जहाँ Q उष्मा ऊर्जा की मात्रा को जोड़ा जाता है, m पदार्थ द्रव्यमान है, c विशिष्ट ऊष्मा है, एक स्थिर है, और inT का अर्थ है "तापमान में परिवर्तन।"
सुनिश्चित करें कि माप की आपकी इकाइयाँ विशिष्ट ताप स्थिरांक में प्रयुक्त इकाइयों से मेल खाती हैं! उदाहरण के लिए, कभी-कभी विशिष्ट गर्मी सेल्सियस का उपयोग कर सकती है। अन्य बार, आपको तापमान के लिए SI इकाई मिलती है, जो कि केल्विन है। इन मामलों में, विशिष्ट ऊष्मा के लिए इकाइयाँ या तो जूल / ग्राम ° C होगी या फिर जूल / चना K. वही होगा जो कि द्रव्यमान के लिए ग्राम बनाम किलोग्राम के साथ हो सकता है, या ऊर्जा के लिए बोमू के लिए जूल। इकाइयाँ जाँचना और आरंभ करने से पहले आवश्यक किसी भी रूपांतरण करना सुनिश्चित करें।
प्रारंभिक तापमान का पता लगाने के लिए विशिष्ट गर्मी का उपयोग करना
ΔT भी लिखा जा सकता है (टी - टी0), या एक पदार्थ नया तापमान अपने प्रारंभिक तापमान को घटा देता है। तो विशिष्ट गर्मी के लिए समीकरण लिखने का एक और तरीका है:
क्यू = एमसी (टी - टी0)
तो समीकरण का यह फिर से लिखा रूप प्रारंभिक तापमान को खोजने के लिए सरल बनाता है। आप सभी अन्य मानों को प्लग कर सकते हैं जो आपने दिए हैं, फिर टी के लिए हल करें0.
उदाहरण के लिए: मान लीजिए कि आप 2.0 ग्राम पानी में 75.0 जूल ऊर्जा जोड़ते हैं, जिससे उसका तापमान 87 ° C हो जाता है। वाटर्स विशिष्ट गर्मी 4.184 है जूल / चना ° C। पानी का प्रारंभिक तापमान क्या था?
दिए गए मानों को अपने समीकरण में प्लग करें:
75.o J = 2.0 g x (4.184 J / g ° C) x (87 ° C - t)0).
सरल बनाएं:
75.o J = 8.368 J / ° C x (87 ° C - t0).
8.96 ° C = (87 ° C - t0)
78 ° C = t0.
विशिष्ट गर्मी और चरण परिवर्तन
ध्यान में रखने के लिए एक महत्वपूर्ण अपवाद है। एक चरण परिवर्तन के दौरान विशिष्ट ताप समीकरण काम नहीं करता है, उदाहरण के लिए, एक तरल से एक गैस या एक ठोस से एक तरल तक। Thats क्योंकि सभी अतिरिक्त ऊर्जा thats में पंप किया जा रहा है, चरण परिवर्तन के लिए उपयोग किया जा रहा है, तापमान बढ़ाने के लिए नहीं। तो उस अवधि में तापमान सपाट रहता है, उस स्थिति में ऊर्जा, तापमान और विशिष्ट ऊष्मा के बीच संबंध को समाप्त कर देता है।