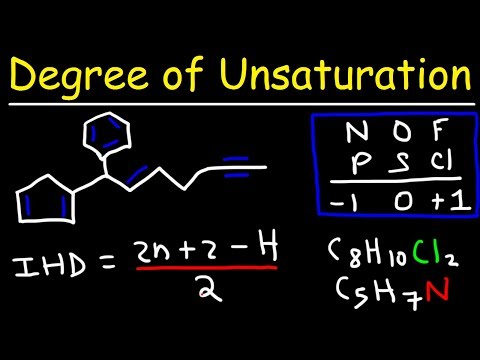
कार्बनिक रसायन विज्ञान में, एक "असंतृप्त" यौगिक वह है जिसमें कम से कम एक "पाई" बॉन्ड होता है - इसके दो कार्बन के बीच एक "डबल" बॉन्ड होता है जो एक के बजाय प्रत्येक कार्बन से दो इलेक्ट्रॉनों का उपयोग करता है। यह निर्धारित करना कि एक असंतृप्त परिसर में कितने पाई बांड हैं - इसकी "असंतोष संख्या" - यदि आप यौगिक को हाथ से निकालना चाहते हैं, तो यह करना कठिन है। यदि, दूसरी ओर, आप इस संख्या की गणना एक साधारण सूत्र केमिस्ट का उपयोग करके करते हैं, तो यह आपको कुछ ही क्षणों में ले जाएगा।
किसी भी हैलोजन को बदलें - जैसे ब्रोमीन, आयोडीन या क्लोरीन - गणना के उद्देश्य के लिए आपके यौगिक में हाइड्रोजेन है। उदाहरण के लिए, यदि आपका कंपाउंड C6H6N3OCl है, तो आप इसे C6H7N3O के रूप में फिर से लिखेंगे।
किसी भी ऑक्सीजेंस की अवहेलना करें जिसमें आपका यौगिक शामिल है - ये असंतोषजनक गणना की डिग्री के लिए प्रासंगिक नहीं हैं। अब आप C6H7N3 के रूप में उदाहरण यौगिक लिखेंगे।
हाइड्रोजन से प्रत्येक नाइट्रोजन को घटाएं। इस उदाहरण में, आप अब C6H4 के रूप में यौगिक का प्रतिनिधित्व कर सकते हैं।
अपने कंपाउंड के लिए असंतृप्त संख्या की गणना करें, जो अब CnHm के रूप में है, इस सूत्र का उपयोग करके m = n - (m / 2) + 1, जहाँ "Ω" असंतोष की डिग्री है - pi की संख्या आपके कंपाउंड के पास है । उदाहरण के लिए कंपाउंड C6H4, इस प्रकार करें: - = 6 - (4/2) + 1 = 6 - 2 + 1 = 5. यौगिक C6H6N3OCl में पांच दोहरे बॉन्ड होते हैं।