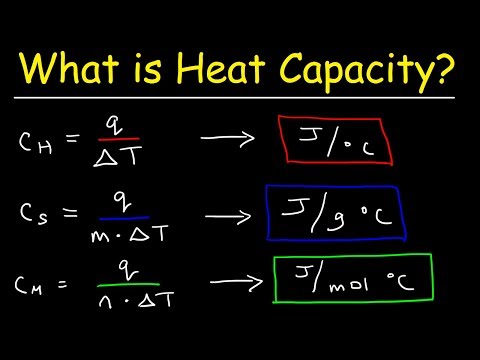
किसी पदार्थ की मोलर ताप क्षमता पदार्थ की एक डिग्री को एक डिग्री तक बढ़ाने के लिए आवश्यक ऊर्जा की मात्रा है। मानक इकाई जूल प्रति मोल K है। एक आवर्त सारणी आमतौर पर किसी तत्व की विशिष्ट ऊष्मा क्षमता को सूचीबद्ध करती है। विशिष्ट ऊष्मा दाढ़ की ताप क्षमता से भिन्न होती है, क्योंकि इसे प्रति तिल के बजाय प्रति ग्राम मापा जाता है। आपके पास मौजूद जानकारी और विचाराधीन पदार्थ के आधार पर, किसी पदार्थ की मोलर ताप क्षमता की गणना एक साधारण रूपांतरण या एक अधिक शामिल गणना हो सकती है।
पदार्थ की विशिष्ट गर्मी का निर्धारण करें। यदि पदार्थ एक एकल तत्व से बना है, तो विशिष्ट गर्मी कई आवधिक तालिकाओं में सूचीबद्ध है। उदाहरण के लिए, चांदी की विशिष्ट गर्मी लगभग 0.23 J / g * K है। यदि पदार्थ कई तत्वों का एक यौगिक है, तो आपको इसकी विशिष्ट गर्मी को या तो प्रयोगात्मक रूप से सत्यापित करने की आवश्यकता होगी, या पहले से मौजूद दस्तावेज़ से (सामान्य विशिष्ट हीट की तालिका के लिए संसाधन देखें)।
पदार्थ के दाढ़ द्रव्यमान की गणना करें। आवर्त सारणी प्रत्येक तत्व के दाढ़ द्रव्यमान को सूचीबद्ध करती है। यदि यह एक यौगिक है, तो दाढ़ द्रव्यमान की गणना अनुपात के माध्यम से की जानी चाहिए। उदाहरण के लिए, पानी के एक मोल में 2 भाग हाइड्रोजन और 1 भाग ऑक्सीजन होता है। पानी का दाढ़ द्रव्यमान इन भागों में से प्रत्येक को तत्वों के संगत द्रव्यमान से गुणा करके प्राप्त किया जाता है:
2 x (1 g / mol हाइड्रोजन) + (16 g / mol oxygen) = 18 g / mol पानी
पदार्थ की दाढ़ द्रव्यमान द्वारा पदार्थ की विशिष्ट गर्मी को गुणा करें। यह पदार्थ की दाढ़ की ऊष्मा क्षमता में परिणाम करता है, जूल में प्रति मोल K. पानी के लिए, उदाहरण के लिए, विशिष्ट ऊष्मा लगभग 4.184 J / (g * K) के रूप में दी जाती है। दाढ़ द्रव्यमान द्वारा इसे गुणा करें:
4.184 x 18 = 75.312 J / (मोल * K)