विषय
तटस्थ प्रतिक्रिया तब होती है जब आप उन्हें निष्क्रिय या तटस्थ प्रदान करने के उद्देश्य से दो अत्यंत प्रतिक्रियाशील पदार्थों को एक साथ जोड़ते हैं। उदाहरण के लिए, एक एसिड और बेस को एक साथ मिलाकर पानी का उत्पादन होता है। तटस्थ प्रतिक्रियाएं ऊर्जा को बंद कर देती हैं, जिसे निष्प्रभावीकरण की गर्मी के रूप में जाना जाता है। न्यूट्रलाइजेशन की मोलर हीट, एसिड (या इसके विपरीत) में जोड़े गए बेस के प्रत्येक मोल की मात्रा होती है, जो प्रतिक्रिया देने का कारण बनती है। (एक तिल एक इकाई रसायनज्ञ है जो बड़ी संख्या में अणुओं का प्रतिनिधित्व करने के लिए उपयोग करता है।) एक बार जब आप तापमान में होने वाले परिवर्तन को निर्धारित करते हैं, तो शेष सरल होता है।
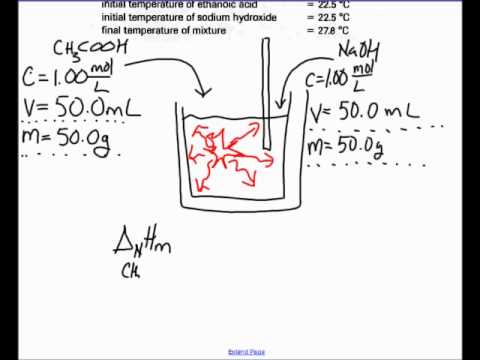
एक इलेक्ट्रॉनिक संतुलन पर अपने एसिड का वजन। संतुलन पर एक खाली बीकर रखें और बीकर के वजन को रद्द करने के लिए टारे बटन को हिट करें, फिर अपने एसिड को बीकर में डालें और संतुलन पर रखें। अपने एसिड का द्रव्यमान रिकॉर्ड करें।
एक कैलोरीमीटर का उपयोग करके प्रतिक्रिया के दौरान होने वाले तापमान में परिवर्तन की गणना करें, उपकरण का एक टुकड़ा जो दोनों तापमान को मापता है और अभिकारक को धारण करता है। अपने आधार को कैलोरीमीटर में जोड़ें और कैलोरीमीटर मुंह के नीचे अपना एसिड (इसके बीकर में) रखें। एसिड में कैलोरीमीटर थर्मामीटर डालें और प्रारंभिक तापमान पढ़ें। आधार की मात्रा जोड़ें जो आपकी प्रतिक्रिया आपके एसिड को निर्दिष्ट करती है, फिर तापमान में परिवर्तन को निर्धारित करने के लिए अपनी कैलोरीमीटर पढ़ें।
फोमुला Q = mc ,T का उपयोग करके न्यूट्रलाइज़ेशन की गर्मी की गणना करें, जहाँ "क्यू" न्यूट्रलाइज़ेशन की गर्मी है, "एम" आपके एसिड का द्रव्यमान है, "c" जलीय विलयन के लिए विशिष्ट ताप क्षमता है, 4.18% जूल (ग्राम x °) C), और ""T" आपके कैलोरीमीटर का उपयोग करके आपके द्वारा मापा गया तापमान में परिवर्तन है। उदाहरण के लिए, यदि आप 26.5 डिग्री सेल्सियस पर 34.5 ग्राम हाइड्रोक्लोरिक एसिड के साथ शुरू करते हैं और इसका तापमान 29.1 डिग्री सेल्सियस तक बढ़ जाता है जब आप इसमें सोडियम हाइड्रॉक्साइड जोड़ते हैं, तो न्यूट्रलाइजेशन की गर्मी की गणना निम्नानुसार करते हैं: क्यू = एमसीटीटी = (34.5 gx 4.1814 J) X ((gx ° C) x 3.1 ° C) = 447.48 जूल।
आधार के मोल्स की संख्या की गणना करें जो आप न्यूट्रलाइजेशन के मोलर हीट को निर्धारित करने के लिए जोड़ते हैं, समीकरण numberH = Q = n का उपयोग करके व्यक्त किया जाता है, जहां "n" मोल्स की संख्या है। उदाहरण के लिए, मान लीजिए कि आपने 447.78 जूल के न्यूट्रलाइजेशन की गर्मी पैदा करने के लिए अपने HCl में 25 M 1.0 M NaOH जोड़ा है। (ध्यान रखें कि 1.0 M का अर्थ है प्रति लीटर एक मोल।) चूंकि आपने NaOH के 25 एमएल (25/1000, या .025 L) को जोड़ा है, इसलिए निम्नानुसार मोल्स निर्धारित करें: 1.0 mol / L x .025 L = .025 mol। इस उदाहरण में, न्यूट्रलाइज़ेशन की आपकी मोलर हीट, isH, 447.48 जूल प्रति .025 मोल की NaOH जोड़ी गई है - 447.48 / .025, या 17,900 जूल प्रति मोल।