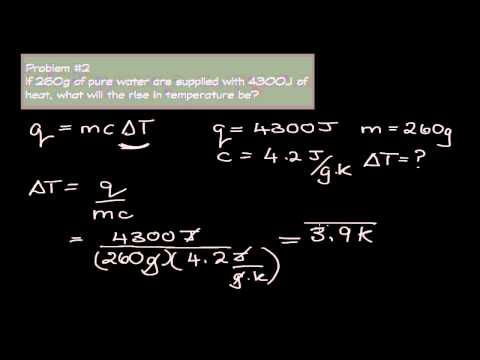
विषय
- टीएल; डीआर (बहुत लंबा; डिडंट रीड)
- गर्मी और तापमान के बीच अंतर क्या है?
- तापमान गणना में सरल परिवर्तन
- हीट ट्रांसफर से तापमान में बदलाव की गणना
ऊष्मा गतिकी तापमान, ऊष्मा और अंतत: ऊर्जा स्थानान्तरण से संबंधित भौतिकी का क्षेत्र है। यद्यपि थर्मोडायनामिक्स के नियम का पालन करने के लिए थोड़ा मुश्किल हो सकता है, थर्मोडायनामिक्स का पहला कानून काम, गर्मी जोड़ा, और किसी पदार्थ की आंतरिक ऊर्जा में परिवर्तन के बीच एक सरल संबंध है। यदि आपको तापमान में बदलाव की गणना करनी है, तो यह या तो पुराने तापमान को नए से घटाने की एक सरल प्रक्रिया है, या इसमें पहला कानून शामिल हो सकता है, ऊष्मा के रूप में जोड़ी गई ऊर्जा की मात्रा और पदार्थ की विशिष्ट ऊष्मा क्षमता सवाल।
टीएल; डीआर (बहुत लंबा; डिडंट रीड)
प्रारंभिक तापमान से अंतिम तापमान को घटाकर तापमान में एक साधारण बदलाव की गणना की जाती है। आपको फ़ारेनहाइट से सेल्सियस या इसके विपरीत में बदलने की आवश्यकता हो सकती है, जिसे आप एक सूत्र या ऑनलाइन कैलकुलेटर का उपयोग करके कर सकते हैं।
जब गर्मी हस्तांतरण शामिल होता है, तो इस सूत्र का उपयोग करें: तापमान में परिवर्तन की गणना करने के लिए तापमान = क्यू / सेमी में एक विशेष मात्रा में गर्मी से जोड़ा जाता है। क्यू जोड़ा गर्मी का प्रतिनिधित्व करता है, सी उस पदार्थ की विशिष्ट ऊष्मा क्षमता है जिसे आप गर्म कर रहे हैं, और म उस पदार्थ का द्रव्यमान है जिसे आप गर्म कर रहे हैं।
गर्मी और तापमान के बीच अंतर क्या है?
तापमान गणना के लिए आपको जिस पृष्ठभूमि की आवश्यकता होती है, वह महत्वपूर्ण है गर्मी और तापमान के बीच का अंतर। किसी पदार्थ का तापमान ऐसा कुछ है जिससे आप रोजमर्रा के जीवन से परिचित हैं। यह वह मात्रा है जिसे आप थर्मामीटर से मापते हैं। आप यह भी जानते हैं कि पदार्थों के क्वथनांक और गलनांक उनके तापमान पर निर्भर करते हैं। वास्तव में, तापमान एक आंतरिक ऊर्जा का एक उपाय है जो किसी पदार्थ में होता है, लेकिन तापमान में परिवर्तन को काम करने के लिए यह जानकारी महत्वपूर्ण नहीं है।
गर्मी थोड़ी अलग है। यह थर्मल विकिरण के माध्यम से ऊर्जा के हस्तांतरण के लिए एक शब्द है। ऊष्मप्रवैगिकी का पहला नियम कहता है कि ऊर्जा में परिवर्तन गर्मी के जोड़ और किए गए कार्यों के बराबर है। दूसरे शब्दों में, आप इसे वार्म अप करके (उस पर गर्मी स्थानांतरित करके) या शारीरिक रूप से इसे हिलाकर या इस पर काम करके (इसे काम करने के लिए) अधिक ऊर्जा दे सकते हैं।
तापमान गणना में सरल परिवर्तन
सबसे सरल तापमान गणना जो आपको करनी पड़ सकती है, उसमें एक शुरुआती और परिष्करण तापमान के बीच के अंतर को काम करना शामिल है। यह आसान है। आप अंतर खोजने के लिए शुरुआती तापमान से अंतिम तापमान घटाते हैं। इसलिए यदि कोई चीज 50 डिग्री सेल्सियस से शुरू होती है और 75 डिग्री सेल्सियस पर खत्म होती है, तो तापमान में परिवर्तन 75 डिग्री सेल्सियस - 50 डिग्री सेल्सियस = 25 डिग्री सेल्सियस है। तापमान में कमी के लिए, परिणाम नकारात्मक है।
इस प्रकार की गणना के लिए सबसे बड़ी चुनौती तब होती है जब आपको तापमान रूपांतरण करने की आवश्यकता होती है। दोनों तापमान या तो फारेनहाइट या सेल्सियस होना चाहिए। यदि आपके पास प्रत्येक में से एक है, तो उनमें से एक को परिवर्तित करें। फ़ारेनहाइट से सेल्सियस पर जाने के लिए, फ़ारेनहाइट में राशि से 32 घटाएं, परिणाम को 5 से गुणा करें, और फिर इसे 9 से विभाजित करें। सेल्सियस से फ़ारेनहाइट में बदलने के लिए, पहले राशि को 9 से गुणा करें, फिर इसे 5 से विभाजित करें, और अंत में इसे विभाजित करें। परिणाम में 32 जोड़ें। वैकल्पिक रूप से, बस एक ऑनलाइन कैलकुलेटर का उपयोग करें।
हीट ट्रांसफर से तापमान में बदलाव की गणना
यदि आप हीट ट्रांसफर से जुड़ी अधिक जटिल समस्या कर रहे हैं, तो तापमान में परिवर्तन की गणना करना अधिक कठिन है। आपके लिए आवश्यक सूत्र है:
तापमान में बदलाव = क्यू / सेमी
कहाँ पे क्यू क्या गर्मी जोड़ी गई है, सी पदार्थ की विशिष्ट ऊष्मा क्षमता है, और म उस पदार्थ का द्रव्यमान है जिसे आप गर्म कर रहे हैं।ताप जूल (J) में दिया जाता है, विशिष्ट ताप क्षमता जूल प्रति किलोग्राम (या ग्राम) ° C में एक मात्रा है, और द्रव्यमान किलोग्राम (किलो) या ग्राम (g) में है। पानी की एक विशिष्ट ताप क्षमता है, जो केवल 4.2 J / g ° C से कम है, इसलिए यदि आप 4,200 J ताप का उपयोग करके 100 ग्राम पानी का तापमान बढ़ा रहे हैं, तो आपको यह मिलेगा:
तापमान में परिवर्तन = 4200 J ÷ (4.2 J / g ° C × 100 g) = 10 ° C
पानी में तापमान 10 डिग्री सेल्सियस बढ़ जाता है। केवल एक चीज जो आपको याद रखने की आवश्यकता है वह यह है कि आपको द्रव्यमान के लिए लगातार इकाइयों का उपयोग करना होगा। यदि आपके पास जे / जी डिग्री सेल्सियस में एक विशिष्ट गर्मी क्षमता है, तो आपको ग्राम में पदार्थ के द्रव्यमान की आवश्यकता होती है। यदि आपके पास जे / किग्रा डिग्री सेल्सियस में है, तो आपको किलोग्राम में पदार्थ के द्रव्यमान की आवश्यकता होती है।