विषय
- टीएल; डीआर (बहुत लंबा; डिडंट रीड)
- इलेक्ट्रॉन विन्यास
- कॉन्फ़िगरेशन के लिए शॉर्टहैंड नोटेशन
- कक्षीय आरेख
- डॉट डायग्राम
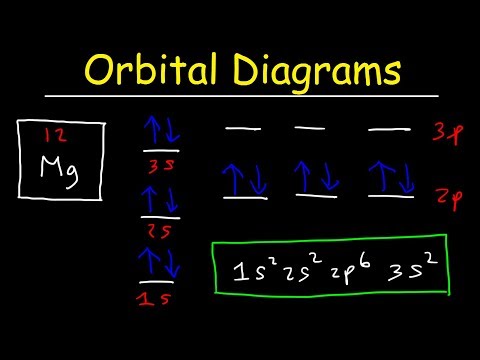
इलेक्ट्रॉन कक्षीय आरेख और लिखित विन्यास आपको बताते हैं कि कौन सी कक्षाएँ भरी हुई हैं और जो किसी भी परमाणु के लिए आंशिक रूप से भरी हुई हैं। वैलेंस इलेक्ट्रॉनों की संख्या उनके रासायनिक गुणों पर प्रभाव डालती है, और कक्षा में विशिष्ट आदेश और गुण भौतिक विज्ञान में महत्वपूर्ण हैं, इसलिए कई छात्रों को मूल बातें पकड़नी पड़ती हैं। अच्छी खबर यह है कि ऑर्बिटल आरेख, इलेक्ट्रॉन विन्यास (शॉर्टहैंड और फुल फॉर्म दोनों) और इलेक्ट्रॉनों के लिए डॉट आरेख वास्तव में समझने में आसान हैं, जब आप कुछ मूल बातें समझ लेते हैं।
टीएल; डीआर (बहुत लंबा; डिडंट रीड)
इलेक्ट्रॉन विन्यास में प्रारूप है: 1 s2 2s2 2p6 । पहला नंबर प्रिंसिपल क्वांटम नंबर (n) है और अक्षर एल के मान का प्रतिनिधित्व करता है (कोणीय गति क्वांटम संख्या; 1 = s, 2 = p, 3 = d और 4 = f) कक्षीय के लिए, और सुपरस्क्रिप्ट शब्द बताता है आप उस परिक्रमा में कितने इलेक्ट्रॉन हैं। ऑर्बिटल आरेख समान मूल प्रारूप का उपयोग करते हैं, लेकिन इलेक्ट्रॉनों के लिए संख्याओं के बजाय, वे ↑ और well तीरों का उपयोग करते हैं, साथ ही साथ प्रत्येक कक्षीय को अपनी लाइन देते हैं, इलेक्ट्रॉनों के स्पिन का भी प्रतिनिधित्व करते हैं।
इलेक्ट्रॉन विन्यास
इलेक्ट्रॉन विन्यास एक संकेतन के माध्यम से व्यक्त किए जाते हैं जो इस तरह दिखता है: 1 s2 2s2 2p1। इस संकेतन के तीन मुख्य भागों को जानें कि यह कैसे काम करता है। पहली संख्या आपको "ऊर्जा स्तर," या प्रमुख क्वांटम संख्या (एन) बताती है। दूसरा अक्षर आपको (l), कोणीय गति क्वांटम संख्या का मान बताता है। L = 1 के लिए, अक्षर s है, l = 2 के लिए यह p है, l = 3 के लिए यह d है, l = 4 के लिए यह f है और उच्च संख्या के लिए यह इस बिंदु से वर्णानुक्रम में वृद्धि करता है।याद रखें कि s ऑर्बिटल्स में अधिकतम दो इलेक्ट्रॉन होते हैं, p ऑर्बिटल्स अधिकतम छह, d अधिकतम 10 और f अधिकतम 14।
Aufbau सिद्धांत आपको बताता है कि सबसे कम-ऊर्जा ऑर्बिटल्स पहले भरते हैं, लेकिन विशिष्ट क्रम इस तरह से अनुक्रमिक नहीं है कि याद रखना आसान है। एक आरेख के लिए संसाधन देखें, जो क्रम को दर्शाता है। ध्यान दें कि n = 1 स्तर में केवल ऑर्बिटल्स हैं, n = 2 स्तर में केवल s और p ऑर्बिटल्स हैं, और n = 3 स्तर में केवल s, p और d ऑर्बिटल्स हैं।
इन नियमों के साथ काम करना आसान है, इसलिए स्कैंडियम के विन्यास के लिए अंकन है:
1s2 2s2 2p6 3s2 3p6 4s2 3 डी1
जो दर्शाता है कि पूरे n = 1 और n = 2 स्तर भरे हुए हैं, n = 4 स्तर की शुरुआत की गई है, लेकिन 3 डी शेल में केवल एक इलेक्ट्रॉन होता है, जबकि इसकी अधिकतम अधिभोग 10. है। यह इलेक्ट्रॉन वैलेंस इलेक्ट्रॉन है।
केवल इलेक्ट्रॉनों की गिनती करके और एक मिलान परमाणु संख्या के साथ तत्व को खोजने के द्वारा संकेतन से एक तत्व को पहचानें।
कॉन्फ़िगरेशन के लिए शॉर्टहैंड नोटेशन
भारी तत्वों के लिए हर एक कक्षीय लिखना कठिन है, इसलिए भौतिक विज्ञानी अक्सर शॉर्टहैंड नोटेशन का उपयोग करते हैं। यह एक प्रारंभिक बिंदु के रूप में महान गैसों (आवर्त सारणी के दाहिने स्तंभ में) का उपयोग करके और उन पर अंतिम कक्षा को जोड़कर काम करता है। तो स्कैंडियम का आर्गन के समान विन्यास है, दो अतिरिक्त कक्षाओं में इलेक्ट्रॉनों के अलावा। शॉर्टहैंड फॉर्म इसलिए:
4s2 3 डी1
क्योंकि आर्गन का विन्यास है:
= 1 एस2 2s2 2p6 3s2 3p6
आप इसका उपयोग हाइड्रोजन और हीलियम के अलावा किसी भी तत्व के साथ कर सकते हैं।
कक्षीय आरेख
ऑर्बिटल आरेख केवल पेश किए गए कॉन्फ़िगरेशन संकेतन की तरह हैं, सिवाय इसके कि इलेक्ट्रॉनों के संकेत के साथ। गोले कैसे भरें, यह जानने के लिए पाउली अपवर्जन सिद्धांत और हंड के नियम का उपयोग करें। बहिष्करण सिद्धांत में कहा गया है कि कोई भी दो इलेक्ट्रॉन समान चार क्वांटम संख्याओं को साझा नहीं कर सकते हैं, जिसके परिणामस्वरूप मूल रूप से विपरीत जीन वाले इलेक्ट्रॉनों के जोड़े होते हैं। हंड के नियम में कहा गया है कि सबसे स्थिर विन्यास समांतर स्पिन की उच्चतम संभव संख्या वाला है। इसका मतलब यह है कि आंशिक रूप से पूर्ण गोले के लिए कक्षीय आरेख लिखते समय, किसी भी डाउन-स्पिन इलेक्ट्रॉनों को जोड़ने से पहले सभी अप-स्पिन इलेक्ट्रॉनों में भरें।
यह उदाहरण दिखाता है कि कक्षीय आरेख कैसे काम करते हैं, उदाहरण के लिए आर्गन का उपयोग करते हुए:
3 पी ↓ p ↑ ↓ ↓ ↓
3s ↓ ↓
2 पी ↓ p ↑ ↓ ↑ ↓
2s ↑ ↓
1s ↓ ↓
इलेक्ट्रॉनों को तीरों द्वारा दर्शाया जाता है, जो उनके स्पिन को भी इंगित करता है, और बाईं ओर अंकन मानक इलेक्ट्रॉन कॉन्फ़िगरेशन संकेतन है। ध्यान दें कि उच्च-ऊर्जा ऑर्बिटल्स आरेख के शीर्ष पर हैं। आंशिक रूप से पूर्ण शेल के लिए, हंड के नियम की आवश्यकता है कि वे इस तरह से भरे हुए हैं (उदाहरण के रूप में नाइट्रोजन का उपयोग करके)।
2 पी ↑ p ↑
2s ↑ ↓
1s ↓ ↓
डॉट डायग्राम
डॉट आरेख कक्षीय आरेखों से बहुत अलग हैं, लेकिन वे अभी भी समझने में बहुत आसान हैं। वे केंद्र में तत्व के लिए प्रतीक से मिलकर होते हैं, जो चारों ओर से घेरे हुए इलेक्ट्रॉनों की संख्या को इंगित करते हैं। उदाहरण के लिए, कार्बन में चार वैलेंस इलेक्ट्रॉन और प्रतीक C हैं, इसलिए इसे इस रूप में दर्शाया गया है:
∙
∙ सी ∙
∙
और ऑक्सीजन (O) में छह हैं, इसलिए इसे इस प्रकार दर्शाया गया है:
∙
∙ ओ ∙
∙∙
जब इलेक्ट्रॉनों को दो परमाणुओं (सहसंयोजक बंधन में) के बीच साझा किया जाता है, तो परमाणु उसी तरह से आरेख में डॉट साझा करते हैं। यह रासायनिक संबंध को समझने के लिए दृष्टिकोण को बहुत उपयोगी बनाता है।