विषय
सांद्रता को मापने के लिए एसिड-बेस अनुमापन एक सीधा तरीका है। रसायनज्ञ एक टाइट्रेंट, एक एसिड या ज्ञात एकाग्रता के आधार को जोड़ते हैं और फिर पीएच में परिवर्तन की निगरानी करते हैं। एक बार जब पीएच समतुल्यता बिंदु तक पहुंच जाता है, तो मूल समाधान में सभी एसिड या बेस को बेअसर कर दिया जाता है। जोड़े गए टाइटेंट की मात्रा को मापकर, रसायनज्ञ मूल समाधान की एकाग्रता का निर्धारण कर सकता है। यह प्रक्रिया एसिड और बेस के लिए लागू होती है जो केवल एक हाइड्रोजन आयन को दान / स्वीकार करते हैं। सल्फ्यूरिक एसिड जैसे अन्य यौगिकों में कई तुल्यता बिंदु होते हैं, इसलिए उनके अनुमापन घटता अधिक जटिल होते हैं।
तुल्यता बिंदु पर पीएच का अनुमान लगाएं। समाधान में एक मजबूत एसिड या आधार के लिए, तुल्यता पर पीएच 0. होगा। जब एक मजबूत एसिड कमजोर आधार के साथ प्रतिक्रिया करता है, हालांकि, वे एक अम्लीय नमक बनाते हैं, इसलिए तुल्यता पर पीएच 7 से कम होगा, जबकि पीएच एक कमजोर एसिड के साथ प्रतिक्रिया करने वाला एक मजबूत आधार एक ही कारण से 7 से अधिक होगा।
यह निर्धारित करने का एक अच्छा तरीका है कि आप क्या उम्मीद करेंगे कि तटस्थकरण प्रतिक्रिया के लिए रासायनिक समीकरण लिखना और उत्पादों की पहचान करना है। एक बार जब सभी एसिड या बेस को बेअसर कर दिया जाता है, तो उत्पाद सभी बचे हुए हो जाएंगे, इसलिए वे पीएच का निर्धारण करेंगे।
पीएच के आधार पर एक पीएच इंडिकेटर का चयन करें जो आप समतुल्यता की अपेक्षा करते हैं। एक पीएच संकेतक चुनें जो पीएच में या उसके समीप बिंदु पर आपकी अपेक्षा के अनुसार रंग बदलता है।
रासायनिक छप चश्मे, प्रयोगशाला कोट और दस्ताने पर रखो। सुरक्षा के लिए धूआं हुड के तहत इस प्रयोग के शेष का संचालन करें।
टाइट्रेंट के साथ मूत्रवर्धक भरें। सबसे उपयुक्त टाइटन चुनें। टाइटेंट को पतला करें और उसकी एकाग्रता को रिकॉर्ड करें। याद रखें कि टाइट्रेट को पतला करते समय एसिड को हमेशा पानी में जोड़ा जाना चाहिए, न कि दूसरे तरीके से। मजबूत एसिड या ठिकानों को आम तौर पर टाइटन्ट के रूप में उपयोग किया जाता है; टाइट्रेंट के रूप में कमजोर एसिड या बेस का उपयोग करके समतुल्यता बिंदु को खोजने में अधिक कठिन है। सोडियम हाइड्रॉक्साइड जैसे मजबूत आधार के साथ एक अम्लीय घोल को टिट्रेट करें। हाइड्रोक्लोरिक / म्यूरिएटिक एसिड जैसे एक मजबूत एसिड के साथ एक मूल समाधान का टाइट्रेट करें।
फ्लास्क या बीकर को मूत्रवर्धक के नीचे रखें। फ्लास्क में निहित समाधान की मात्रा रिकॉर्ड करें।
बीकर / फ्लास्क में धीरे-धीरे टाइट्रेंट डालें। तुल्यता बिंदु पर पीएच परिवर्तन नाटकीय है और जल्दी से होता है। जैसे ही पीएच इंडिकेटर रंग बदलता है, टाइट्रेंट जोड़ना बंद कर देता है और आपके द्वारा जोड़े गए टाइट्रेंट की मात्रा रिकॉर्ड करता है। मूत्रवर्धक में आम तौर पर किनारे पर मात्रा के निशान होंगे, इसलिए आप यह निर्धारित कर सकते हैं कि आपने कितनी मात्रा में उपयोग किया है।
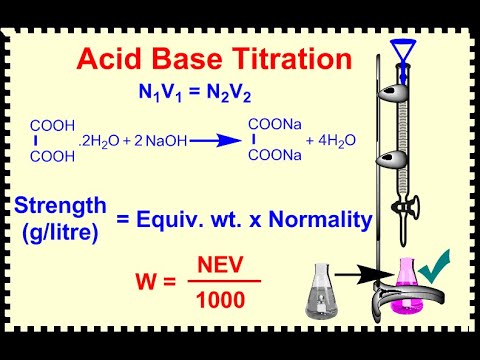
टाइट्रेंट में एसिड या बेस की सांद्रता द्वारा आपके द्वारा उपयोग किए जाने वाले टाइट्रेंट की मात्रा को गुणा करके जोड़े गए टाइट्रेंट के मोल्स की संख्या की गणना करें। तुल्यता बिंदु तक पहुंचने के लिए जोड़े गए मोल्स की संख्या मूल रूप से समाधान में मौजूद एसिड या बेस के मोल्स की संख्या के बराबर है।
मूल समाधान की प्रति लीटर या एकाग्रता प्राप्त करने के लिए अनुमापन से पहले फ्लास्क या बीकर में लीटर की संख्या से एसिड या बेस के मोल्स की संख्या को विभाजित करें।