
विषय
बस उनकी गणना करने के लिए, केमिस्टों ने एक विशेष यौगिक के परमाणुओं की संख्या के लिए एक मानक इकाई बनाई जो एक प्रतिक्रिया या किसी अन्य रासायनिक प्रक्रिया में शामिल थी। वे किसी भी पदार्थ की मात्रा के रूप में एक मोल (मोल) को परिभाषित करते हैं जिसकी मूल इकाइयों की संख्या 12 ग्राम कार्बन -12 के समान है, जो कि एवोगैड्रो संख्या (6.022 × 10) है23)। माप की एसआई (मीट्रिक) प्रणाली एक मिलिमोल (एमएमओएल) को एक मोल के एक हजारवें हिस्से के रूप में परिभाषित करती है। आप आम तौर पर किसी पदार्थ के मोल्स की संख्या की गणना करते हैं जो आपके हाथ में है। यदि आप Mmol में कनवर्ट करना चाहते हैं, तो 10 से गुणा करें3 (1,000).
टीएल; डीआर (बहुत लंबा; डिडंट रीड)
एक तिल एक विशेष परिसर के कणों के एवोगैड्रो संख्या के बराबर है। एक मिलीमोल (Mmol) एक मोल का एक हजारवां हिस्सा है।
मोल्स की गणना कैसे करें
परमाणु द्रव्यमान को परमाणु द्रव्यमान इकाइयों (AMU) में मापा जाता है। एक एएमयू अपने भू-अवस्था में कार्बन -12 परमाणु के नाभिक का द्रव्यमान 1/12 है। किसी पदार्थ का एक मोल उस पदार्थ के कणों के एवोगैड्रो संख्या के बराबर माना जाता है। इस परिभाषा के अनुसार, किसी पदार्थ के एक तिल का वजन एएमयू में उस पदार्थ के एक व्यक्तिगत कण के वजन के बराबर होता है। उदाहरण के लिए, कार्बन -12 का परमाणु भार 12 AMU है, इसलिए कार्बन -12 के एक तिल का वजन 12 ग्राम है।
हाइड्रोजन गैस (H) से भरे कंटेनर पर विचार करें2)। कंटेनर में प्रत्येक कण दो हाइड्रोजन परमाणुओं से युक्त एक अणु है, इसलिए आपको आणविक भार की गणना करने के लिए हाइड्रोजन के परमाणु द्रव्यमान को जानने की आवश्यकता है। आवर्त सारणी के अधिकांश संस्करण अपने प्रतीक के तहत प्रत्येक तत्व के परमाणु द्रव्यमान को सूचीबद्ध करते हैं। हाइड्रोजन के लिए, जिसके नाभिक में एक एकल प्रोटॉन होता है, इसका 1.008 AMU, जो हाइड्रोजन के सभी स्वाभाविक रूप से होने वाले आइसोटोप का औसत है। नतीजतन, हाइड्रोजन गैस का परमाणु द्रव्यमान 2.016 AMU है, और हाइड्रोजन गैस के एक तिल का वजन 2.016 ग्राम है। अपने नमूने में मोल्स की संख्या का पता लगाने के लिए, आप नमूने को ग्राम में तौलेंगे और उस वजन को हाइड्रोजन गैस के आणविक भार से विभाजित करेंगे। उदाहरण के लिए, 15 ग्राम शुद्ध हाइड्रोजन गैस के एक नमूने में 7.44 मोल होते हैं।
ममोल में परिवर्तित
कभी-कभी जांच के तहत मात्रा इतनी कम होती है कि उन्हें मोल्स में व्यक्त करना बोझिल होता है। मिलिमोल में प्रवेश करें। मोल्स की संख्या को हजार से गुणा करके, आप बहुत कम संख्या को अधिक प्रबंधनीय में बदल सकते हैं। यह विशेष रूप से सुविधाजनक है जब मिलीलीटर के क्रम में वॉल्यूम इकाइयों के साथ काम करना।
1 मोल = 1,000 ममोल
समाधान एकाग्रता
केमिस्ट समाधान में एक विशेष यौगिक की एकाग्रता के उपाय के रूप में दाढ़ का उपयोग करते हैं। वे मोलरिटी को प्रति लीटर मोल्स की संख्या के रूप में परिभाषित करते हैं। आप molarity को 1,000 से गुणा करके मिलिमोलरिटी में परिवर्तित करते हैं। उदाहरण के लिए, 1 मोल (दाढ़, जिसे एम भी लिखा जाता है) घोल में प्रति लीटर 1 मोल की सांद्रता होती है। यह 1,000 Mmol (मिलीमीटर, जिसे कभी-कभी mM) समाधान के रूप में भी लिखा जाता है, के बराबर होता है, जिसमें एक वह होता है जिसमें 1,000 Mmol प्रति लीटर होता है।
उदाहरण
••• डेमियन स्कोगिन / डिमांड मीडिया
एक समाधान में 0.15 ग्राम कैल्शियम कार्बोनेट होता है। कितने मिलीमीटर है?
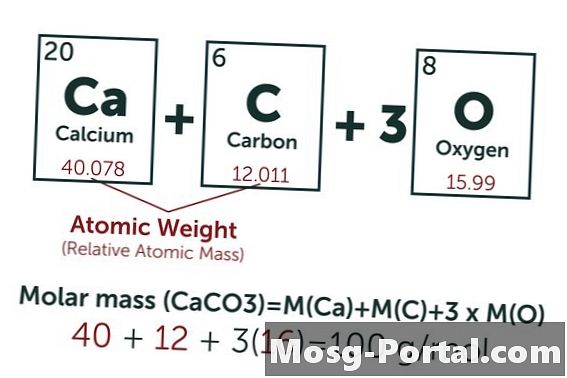
कैल्शियम कार्बोनेट का रासायनिक सूत्र CaCO है3। कार्बन का परमाणु भार (C) लगभग 12 AMU है, ऑक्सीजन का (O) लगभग 16 AMU और कैल्शियम का (Ca) लगभग 40 AMU है। कैल्शियम कार्बोनेट के प्रत्येक अणु का वजन 100 एएमयू होता है, जिसका अर्थ है कि एक तिल का वजन लगभग 100 ग्राम होता है। 0.15 ग्राम का वजन 0.15 ग्राम / 100 ग्राम / मोल = 0.0015 मोल्स का प्रतिनिधित्व करता है। यह 1.5 Mmol के बराबर है।
2.5 लीटर घोल में इतनी अधिक कैल्शियम कार्बोनेट की मात्रा और मात्रा क्या है?
मोलरिटी को मोल्स की संख्या प्रति लीटर के रूप में परिभाषित किया जाता है, इसलिए मोलरिटी प्राप्त करने के लिए मोल्स की संख्या को 2.5 से विभाजित करें: 0.0015 as 2.5 =
0.0006 एम
मिलीमीटर = प्राप्त करने के लिए 1,000 से गुणा करें
0.6 एम.एम.
ध्यान दें कि आप मिलिमोलरिटी के लिए एक ही परिणाम पर पहुंचते हैं यदि आप समाधान की मात्रा से मिलीमोल की संख्या को विभाजित करते हैं।