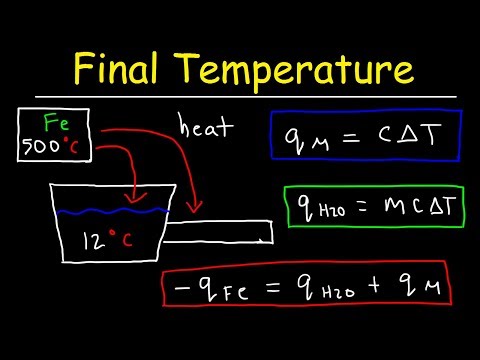
जब आपके पास एक रसायन विज्ञान या भौतिकी समस्या होती है, जो आपको किसी पदार्थ के अंतिम तापमान की गणना करने के लिए कहती है, उदाहरण के लिए, आप एक विशेष शुरुआत के तापमान पर पानी की एक निश्चित मात्रा को लागू करते हैं, तो आप सबसे आम ऊष्मा गतिकी के उपयोग से उत्तर पा सकते हैं। समीकरण। रसायन विज्ञान और भौतिकी के बीच की सीमा को पार करते हुए, थर्मोडायनामिक्स भौतिक विज्ञान की एक शाखा है जिसमें प्रकृति में गर्मी और ऊर्जा के हस्तांतरण और समग्र रूप से ब्रह्मांड है।
विशिष्ट-गर्मी समीकरण को फिर से लिखें, क्यू = एमसीटीटी। अक्षर "क्यू" कैलोरी में विनिमय में हस्तांतरित ऊष्मा है, "मी" ग्राम में गर्म होने वाले पदार्थ का द्रव्यमान है, "c" इसकी विशिष्ट ऊष्मा क्षमता और स्थिर मूल्य है, और ""T" इसका परिवर्तन है तापमान में परिवर्तन को प्रतिबिंबित करने के लिए डिग्री सेल्सियस में तापमान। अंकगणित के नियमों का उपयोग करते हुए, समीकरण के दोनों पक्षों को "mc" द्वारा निम्नानुसार विभाजित करें: Q / mc = mccT / mc, या Q / mc = ΔT।
उन मूल्यों को प्लग करें जो आपकी रसायन विज्ञान की समस्या आपको समीकरण में देते हैं। यदि, उदाहरण के लिए, यह आपको बताता है कि कोई व्यक्ति 150 कैलोरी गर्मी से 25.0 ग्राम पानी में लागू करता है, जिसकी विशिष्ट ताप क्षमता, या तापमान में परिवर्तन का अनुभव किए बिना गर्मी की मात्रा का सामना कर सकता है, तो 1.0 कैलोरी प्रति ग्राम प्रति डिग्री सेल्सियस है, अपने समीकरण को निम्नानुसार आबाद करें: =T = Q / mc = 150 / (25) (1) = 150/25 = 6. इसलिए, आपका पानी 6 डिग्री सेल्सियस तक तापमान में बढ़ जाता है।
अपनी अंतिम गर्मी को खोजने के लिए तापमान में परिवर्तन को अपने पदार्थों के मूल तापमान में जोड़ें। उदाहरण के लिए, यदि आपका पानी शुरू में 24 डिग्री सेल्सियस पर था, तो इसका अंतिम तापमान होगा: 24 + 6, या 30 डिग्री सेल्सियस।